Công thức NaCl đại diện cho muối ăn – một hợp chất đơn giản nhưng có mặt ở khắp nơi trong đời sống. Từ cấu trúc phân tử đến ứng dụng thực tiễn, NaCl đóng vai trò quan trọng trong nhiều lĩnh vực. Sackolik chia sẻ tổng quan ngắn gọn về bản chất hóa học và giá trị thực tế của hợp chất này.
Tổng quan về công thức NaCl
Natri Clorua (NaCl) là một hợp chất vô cơ quen thuộc, thường được gọi là muối ăn. Nó là một trong những chất được sử dụng rộng rãi nhất trong đời sống hàng ngày. Ngoài vai trò là gia vị, NaCl còn có mặt trong nhiều lĩnh vực như y tế, công nghiệp và xử lý nước. Đây cũng là một trong những hợp chất cơ bản được giới thiệu trong chương trình lớp 10 môn Hóa học.

Công thức NaCl biểu thị sự kết hợp giữa hai nguyên tố: natri (Na) và clo (Cl). Trong phản ứng, nguyên tử natri nhường một electron trở thành ion dương Na⁺, còn nguyên tử clo nhận electron trở thành ion âm Cl⁻. Hai ion trái dấu liên kết với nhau bằng lực hút tĩnh điện, tạo thành liên kết ion vững chắc. Liên kết này giúp NaCl có cấu trúc tinh thể bền và ổn định.
NaCl có dạng tinh thể rắn, không màu, thường có màu trắng do tạp chất, và tan dễ dàng trong nước. Nó có vị mặn đặc trưng và là thành phần không thể thiếu trong khẩu phần ăn hàng ngày. Với tính chất trung tính, NaCl rất ổn định trong điều kiện thường và an toàn khi sử dụng. Nhờ những đặc điểm này, NaCl được xem là hợp chất hóa học nền tảng trong cả thực tiễn lẫn lý thuyết.
Cấu tạo phân tử và liên kết trong công thức NaCl
NaCl là một hợp chất ion quen thuộc với công thức hóa học đơn giản nhưng mang trong mình cấu trúc phân tử đặc biệt. Việc tìm hiểu cấu tạo và liên kết trong NaCl giúp lý giải vì sao hợp chất này lại ổn định và có nhiều ứng dụng như vậy.
Liên kết ion giữa natri và clo
Công thức NaCl được hình thành từ sự kết hợp giữa nguyên tử natri (Na) và clo (Cl). Natri nhường một electron để trở thành ion dương (Na⁺), còn clo nhận một electron để trở thành ion âm (Cl⁻). Sự hút tĩnh điện giữa hai ion trái dấu tạo nên liên kết ion bền vững.
Quá trình hình thành ion
Nguyên tử natri có xu hướng mất đi một electron lớp ngoài cùng để đạt cấu hình bền vững như khí hiếm. Trong khi đó, clo lại dễ dàng nhận thêm một electron để đạt cấu hình tương tự. Sự trao đổi electron này diễn ra hoàn toàn và tạo ra hai ion mang điện trái dấu.
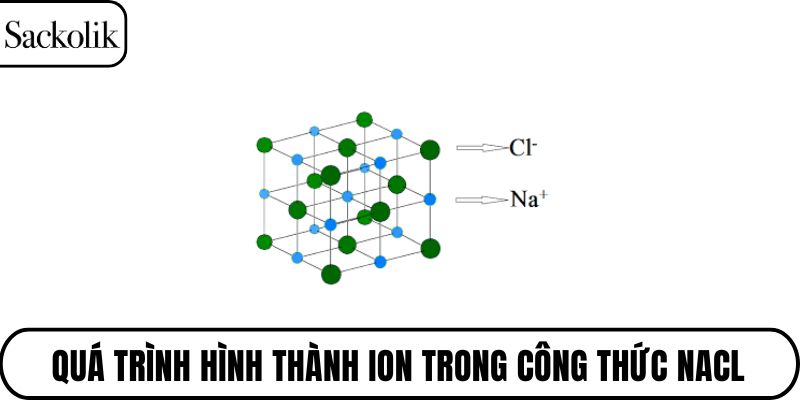
Cấu trúc mạng tinh thể lập phương
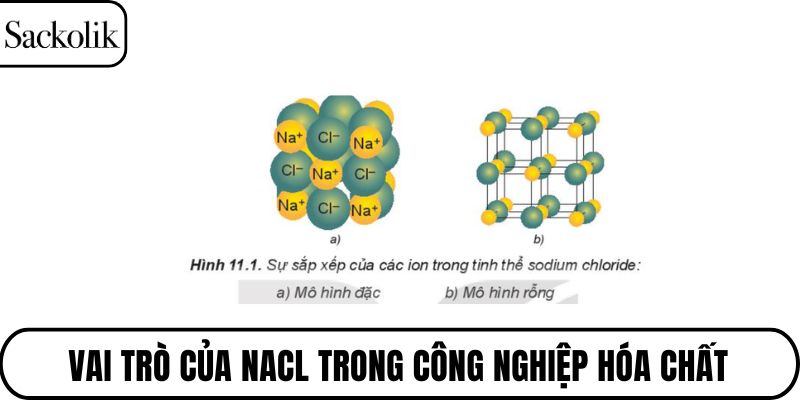
Trong trạng thái rắn, các ion Na⁺ và Cl⁻ không tồn tại riêng lẻ mà sắp xếp theo dạng mạng tinh thể lập phương đều. Mỗi ion Na⁺ được bao quanh bởi sáu ion Cl⁻ và ngược lại. Sự sắp xếp này tạo nên một cấu trúc ổn định và đối xứng.
Lực hút tĩnh điện giữa các ion trong công thức NaCl
Liên kết ion trong công thức NaCl không chỉ là giữa một cặp ion mà còn là tổng hợp của nhiều lực hút giữa các ion xung quanh. Các ion trong mạng tinh thể hút nhau mạnh mẽ bằng lực tĩnh điện. Chính điều này giúp NaCl có điểm nóng chảy và độ bền cao.
Tính chất dẫn điện khi hòa tan hoặc nóng chảy
Ở trạng thái rắn, NaCl không dẫn điện do các ion bị cố định trong mạng tinh thể. Tuy nhiên, khi tan trong nước hoặc bị nung chảy, các ion tự do di chuyển và dẫn điện. Đây là một đặc điểm tiêu biểu của các hợp chất ion như NaCl.
Tính chất hóa học của công thức NaCl
Natri clorua (NaCl) là hợp chất muối có mặt khắp nơi trong đời sống, từ nhà bếp cho đến phòng thí nghiệm. Tuy quen thuộc, nhưng các tính chất hóa học của NaCl lại mang nhiều điểm đặc trưng đáng chú ý khi phân tích dưới góc nhìn hóa học.
Không phản ứng với axit hay bazơ mạnh
Công thức NaCl được tạo thành từ sự trung hòa giữa axit mạnh (HCl) và bazơ mạnh (NaOH), nên nó là một muối trung tính, ổn định. Chính vì vậy, khi cho NaCl vào dung dịch axit mạnh như H₂SO₄ hoặc bazơ mạnh như KOH, không có phản ứng xảy ra. Điều này chứng tỏ NaCl không có tính chất axit hay bazơ và khó bị biến đổi trong các môi trường thông thường.
Có thể tham gia phản ứng trao đổi trong dung dịch
Dù không phản ứng với axit hay bazơ mạnh, công thức NaCl vẫn có thể phản ứng với một số muối khác trong dung dịch. Nếu sản phẩm tạo thành là chất kết tủa, chất khí hoặc chất dễ bay hơi, phản ứng trao đổi ion sẽ xảy ra. Đây là đặc điểm quan trọng trong quá trình phân tích định tính hoặc tổng hợp hóa học.
Điện phân dung dịch NaCl tạo ra nhiều sản phẩm
Khi điện phân dung dịch NaCl có màng ngăn, quá trình sẽ tạo ra khí clo (Cl₂), khí hiđro (H₂), và dung dịch NaOH. Phản ứng điện phân này là nền tảng của nhiều ngành công nghiệp hóa chất như sản xuất xút và clo công nghiệp. Nó cũng thể hiện khả năng phân ly ion mạnh mẽ của NaCl trong dung dịch.

Ổn định nhiệt, không bị phân hủy dễ dàng
NaCl có độ bền cao dưới tác dụng của nhiệt độ thông thường. Ngay cả khi đun nóng đến nhiệt độ vài trăm độ C, nó vẫn giữ nguyên cấu trúc và không bị phân hủy. Điều này phản ánh tính chất đặc trưng của liên kết ion mạnh giữa các ion Na⁺ và Cl⁻.
Không tham gia phản ứng oxi hóa khử thông thường
Công thức NaCl không dễ bị oxi hóa hay khử trong các điều kiện thông thường. Khác với những hợp chất chứa kim loại chuyển tiếp, NaCl không có khả năng nhường hoặc nhận electron trong các phản ứng oxi hóa khử cơ bản. Điều này giúp NaCl duy trì tính ổn định trong nhiều môi trường khác nhau, kể cả khi tiếp xúc với chất oxi hóa mạnh.
Xem thêm: Công Thức HNO3 Có Gì Đặc Biệt Trong Nhóm Các Axit Mạnh?
Ứng dụng và vai trò thực tiễn của công thức NaCl
NaCl không chỉ là một hợp chất phổ biến mà còn đóng vai trò thiết yếu trong nhiều lĩnh vực của đời sống và sản xuất. Theo sackolik, sự hiện diện của NaCl vượt xa khái niệm đơn thuần là muối ăn.
Trong ngành thực phẩm
NaCl là thành phần cơ bản không thể thiếu trong chế biến và bảo quản thực phẩm. Nó giúp tăng hương vị và ức chế sự phát triển của vi sinh vật. Nhờ tính chất này, muối được sử dụng rộng rãi trong các quy trình sản xuất từ truyền thống đến công nghiệp.
Ứng dụng trong y tế
Dung dịch NaCl 0,9% được dùng phổ biến làm nước muối sinh lý để sát trùng, rửa vết thương và truyền dịch. Hợp chất này giúp duy trì áp suất thẩm thấu và cân bằng điện giải trong cơ thể. Ngoài ra, nó còn đóng vai trò hỗ trợ trong nhiều thủ thuật y học khác.
Vai trò trong công nghiệp hóa chất
Công thức NaCl là nguyên liệu đầu vào quan trọng trong sản xuất natri hiđroxit (NaOH), clo (Cl₂) và hydro (H₂) thông qua điện phân. Các sản phẩm này là nền tảng cho hàng loạt quá trình hóa học khác. Vì thế, NaCl giữ vị trí chiến lược trong chuỗi cung ứng công nghiệp.
Xử lý môi trường và đời sống đô thị
Muối được rải trên mặt đường để làm tan băng trong điều kiện thời tiết lạnh. Nó cũng được sử dụng trong xử lý nước sinh hoạt để làm mềm nước cứng. Các ứng dụng này giúp cải thiện điều kiện sống và đảm bảo an toàn giao thông.
Tác động sinh học trong cơ thể người
Công thức NaCl duy trì cân bằng nội môi, điều hòa huyết áp và hỗ trợ hoạt động thần kinh. Sự thiếu hụt hoặc dư thừa đều có thể gây rối loạn sức khỏe. Do đó, lượng NaCl nạp vào cơ thể cần được kiểm soát hợp lý trong chế độ ăn uống hàng ngày.
Kết luận
Công thức NaCl không chỉ là biểu diễn hóa học, mà còn là chìa khóa để hiểu sâu hơn về liên kết ion và muối trong tự nhiên. Từ nhà bếp đến phòng thí nghiệm, vai trò của NaCl luôn hiện diện một cách âm thầm nhưng thiết yếu. Sackolik tổng hợp để nhấn mạnh giá trị khoa học và ứng dụng đời sống của hợp chất phổ biến này.

