Công thức HNO3 là biểu thị hóa học của axit nitric – một hợp chất quan trọng trong nhiều lĩnh vực. Từ cấu trúc đến tính chất phản ứng, HNO3 thể hiện rõ vai trò của một axit mạnh và chất oxi hóa đặc trưng. Bài viết được thực hiện bởi sackolik, cung cấp góc nhìn tổng quan và dễ hiểu về hợp chất này.
Giới thiệu về công thức HNO3
Axit nitric, có công thức hóa học là HNO3, là một axit vô cơ mạnh thuộc nhóm oxoaxit của nitơ. Cách viết đúng là viết hoa chữ H và N, chữ O viết số 3 nhỏ bên dưới, thể hiện đúng thành phần phân tử gồm 1 nguyên tử hydro, 1 nguyên tử nitơ và 3 nguyên tử oxy. Đây là một hợp chất quan trọng trong hóa học với tính oxi hóa rất cao, thường tồn tại dưới dạng dung dịch trong nước.
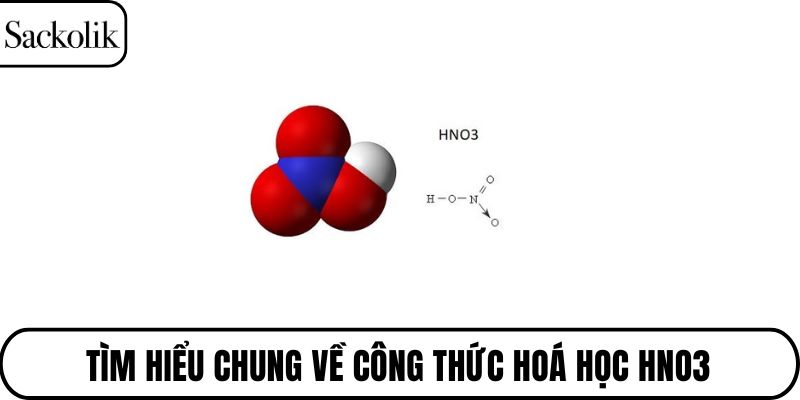
Axit nitric là chất lỏng không màu hoặc hơi vàng nhạt, có mùi hăng, khó chịu. Nó dễ tan trong nước và tạo thành dung dịch axit mạnh. Nhiệt độ sôi của HNO3 khoảng 83°C và có khả năng bay hơi nhanh trong không khí.
Axit nitric được sử dụng rộng rãi trong sản xuất phân bón, đặc biệt là nitrat amoni. Ngoài ra, nó còn là nguyên liệu quan trọng trong công nghiệp hóa chất và luyện kim để xử lý bề mặt kim loại. Trong phòng thí nghiệm, công thức HNO3 cũng thường được dùng để tổng hợp các hợp chất hữu cơ và vô cơ khác.
Cấu tạo và công thức hóa học của HNO3
Axit nitric (HNO3) là một hợp chất vô cơ quen thuộc trong hóa học, thường xuất hiện trong nhiều phản ứng quan trọng. Việc hiểu rõ cấu tạo và công thức của HNO3 giúp làm sáng tỏ tính chất và ứng dụng thực tiễn của nó trong đời sống và công nghiệp.
Công thức phân tử của HNO3
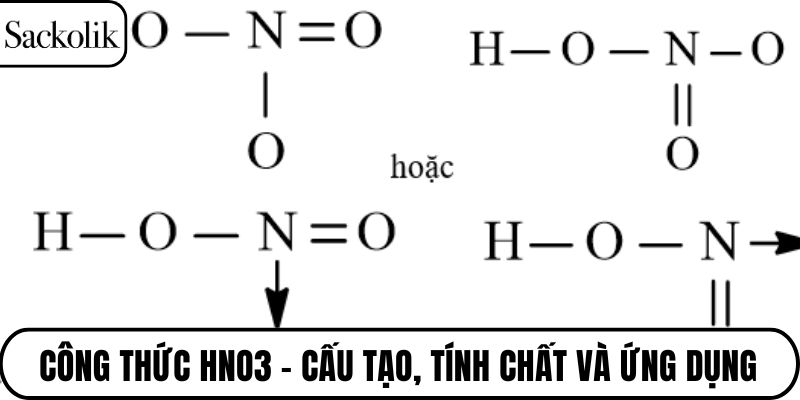
HNO3 có công thức phân tử gồm ba nguyên tố: hydro (H), nitơ (N) và ba nguyên tử oxy (O). Đây là dạng công thức thể hiện tỷ lệ nguyên tử trong phân tử một cách ngắn gọn và phổ biến nhất. Dựa vào công thức này, ta có thể nhận biết công thức HNO3 là một axit mạnh thuộc nhóm oxoaxit.
Cấu trúc phân tử chi tiết
Trong cấu trúc phân tử, nguyên tử nitơ nằm ở trung tâm, liên kết với một nhóm hydroxyl (-OH) và hai nguyên tử oxy, trong đó có một liên kết đôi và một liên kết dương điện. Cấu trúc này tạo nên một hệ thống liên kết cộng hóa trị có cực, khiến HNO3 dễ phân ly. Sự phân bố electron trong phân tử cũng góp phần giải thích tính oxi hóa mạnh của axit này.

Tính chất phân ly trong dung dịch
HNO3 phân ly hoàn toàn trong nước thành ion H⁺ và NO₃⁻. Chính khả năng phân ly mạnh này khiến HNO3 được xếp vào nhóm axit mạnh điển hình. Nhờ đó, nó có khả năng phản ứng dễ dàng với nhiều chất khác, đặc biệt là bazơ và kim loại.
Liên kết và phân cực trong phân tử
Các liên kết trong HNO3 đều là liên kết cộng hóa trị, nhưng mang tính phân cực cao do sự chênh lệch độ âm điện giữa các nguyên tử. Đặc biệt, nhóm -OH có khả năng nhường proton, là nguyên nhân chính tạo nên tính axit. Phân tử HNO3 vì vậy có xu hướng hoạt động mạnh trong môi trường nước và phản ứng với nhiều chất khác.
So sánh công thức HNO3 với các axit oxo khác
So với các axit như H2SO4 hay HClO4, HNO3 có độ mạnh tương đương nhưng tính oxi hóa lại nổi bật hơn. Điều này giúp HNO3 có khả năng tham gia các phản ứng không chỉ với bazơ mà còn với nhiều kim loại và phi kim. Sự khác biệt này bắt nguồn từ cấu trúc đặc trưng có chứa nhóm nitro (NO2) liên kết trực tiếp với nhóm -OH.
Tính chất hóa học của công thức HNO3
Axit nitric là một trong những axit mạnh phổ biến nhất trong hóa học vô cơ. Nó không chỉ tham gia các phản ứng trung hòa thông thường mà còn thể hiện tính oxi hóa mạnh với nhiều chất khác nhau.
Tính oxi hóa mạnh
Công thức HNO3 có khả năng oxi hóa mạnh nhờ chứa nhóm nitrat dễ bị khử. Trong nhiều phản ứng, nó không chỉ đóng vai trò là axit mà còn là chất oxi hóa, làm thay đổi số oxi hóa của các nguyên tố tham gia. Điều này thể hiện rõ khi nó tạo ra các sản phẩm như khí NO, NO2 trong quá trình phản ứng.
Phản ứng với kim loại
Công thức HNO3 phản ứng với hầu hết kim loại trừ một số kim loại thụ động như vàng và platin. Tùy theo nồng độ axit và loại kim loại, sản phẩm có thể là muối nitrat kèm khí NO, NO2 hoặc H2. Đặc biệt, với kim loại như nhôm hay sắt, HNO3 đặc tạo lớp oxit bảo vệ làm ngừng phản ứng, gọi là hiện tượng thụ động hóa.
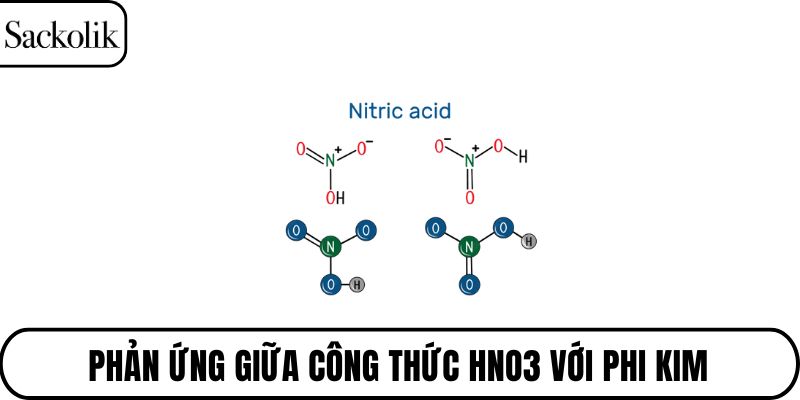
Phản ứng với phi kim
Một số phi kim như lưu huỳnh, cacbon, hoặc photpho có thể phản ứng với HNO3 do tính oxi hóa mạnh của axit này. Trong những phản ứng đó, phi kim thường bị oxi hóa thành hợp chất có oxi như SO2, CO2 hoặc H3PO4. HNO3 đóng vai trò là chất nhận điện tử, bị khử đồng thời sinh ra khí nitơ oxit.
Phản ứng với bazơ
HNO3 dễ dàng phản ứng với các bazơ tan để tạo muối nitrat và nước. Đây là phản ứng trung hòa điển hình, xảy ra nhanh và hoàn toàn khi các chất phản ứng ở dạng dung dịch. Phản ứng này được ứng dụng trong việc điều chế muối nitrat trong phòng thí nghiệm và công nghiệp.
Phản ứng phân hủy
Dưới tác dụng của nhiệt hoặc ánh sáng, công thức HNO3 bị phân hủy thành NO2, O2 và H2O, đặc biệt khi ở trạng thái đậm đặc. Đây là lý do vì sao dung dịch HNO3 lâu ngày thường ngả sang màu vàng nâu do sự tích tụ khí NO2. Quá trình phân hủy này cũng khiến việc bảo quản axit nitric cần chú trọng đến yếu tố ánh sáng và nhiệt độ.
Xem thêm: Công Thức HCl – Từ Cấu Tạo Phân Tử Đến Ứng Dụng Thực Tế
Ứng dụng và ảnh hưởng của công thức HNO3
HNO3 là một hợp chất vô cơ có vai trò quan trọng trong nhiều lĩnh vực công nghiệp và nghiên cứu khoa học. Trên sackolik, nội dung về axit này được trình bày dưới góc nhìn thực tế, phản ánh cả lợi ích lẫn những vấn đề liên quan đến an toàn và môi trường.
Sản xuất phân bón hóa học
HNO3 là nguyên liệu chính để điều chế ammoni nitrat, một loại phân bón phổ biến cung cấp nitơ cho cây trồng. Việc sử dụng phân bón này góp phần cải thiện năng suất và chất lượng nông sản. Tuy nhiên, nếu sử dụng không kiểm soát, nó có thể gây ô nhiễm nguồn nước và làm thoái hóa đất.
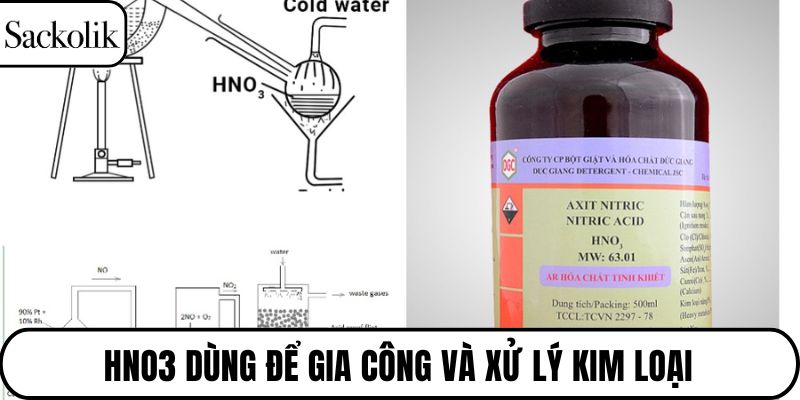
Gia công và xử lý kim loại
Công thức HNO3 thường được dùng để làm sạch và tẩy rửa bề mặt kim loại trong công nghiệp luyện kim. Nó giúp loại bỏ lớp oxit và tạp chất, tạo điều kiện thuận lợi cho các bước xử lý tiếp theo. Tuy nhiên, các khí thải sinh ra trong quá trình này có thể gây hại cho sức khỏe nếu không được xử lý đúng cách.
Chế tạo chất nổ và nhiên liệu tên lửa
Công thức HNO3 là thành phần không thể thiếu trong sản xuất nhiều loại chất nổ công nghiệp và quân sự như TNT hoặc nitroglycerin. Nó cũng được dùng làm chất oxy hóa trong nhiên liệu tên lửa lỏng. Do tính ăn mòn và phản ứng mạnh, HNO3 đòi hỏi quy trình bảo quản và sử dụng cực kỳ nghiêm ngặt.
Ứng dụng trong phòng thí nghiệm
Trong nghiên cứu hóa học, công thức HNO3 được sử dụng để chuẩn bị dung dịch, hòa tan mẫu và phân tích thành phần hóa học. Axit này phản ứng mạnh với nhiều hợp chất, giúp phân hủy các mẫu khó xử lý. Tuy nhiên, cần đảm bảo điều kiện làm việc an toàn để tránh rủi ro khi tiếp xúc.
Kết luận
Công thức HNO3 không chỉ thể hiện sự đơn giản trong biểu diễn mà còn hàm chứa nhiều kiến thức hóa học thú vị. Từ các phản ứng đặc trưng đến ứng dụng thực tiễn, axit nitric là một chất đáng chú ý trong nhiều lĩnh vực. Sackolik hy vọng nội dung trên giúp bạn hiểu rõ hơn về bản chất và vai trò của HNO3.