Công thức HCl là đại diện cho axit clohidric – một hợp chất phổ biến trong hóa học. Đây là một chủ đề cơ bản mà mọi học sinh đều cần nắm vững. Bài viết sau sẽ giúp bạn hiểu sâu hơn về đặc điểm, ứng dụng, phân biệt đúng công thức trong từng ngữ cảnh. Sackolik chia sẻ bài viết nhằm cung cấp thông tin đáng tin cậy đến người đọc.
Tính chất đặc trưng của HCl – Hiểu đúng bản chất hóa học
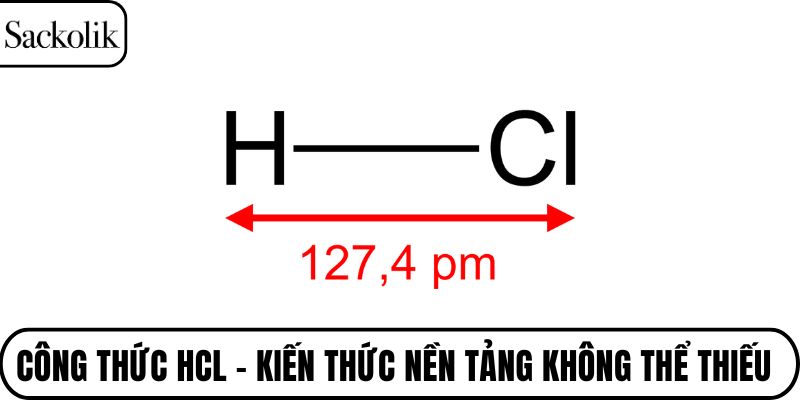
Axit clohidric (HCl) là một axit mạnh được tạo thành từ sự kết hợp giữa khí hydro (H₂), clo (Cl₂) trong điều kiện thích hợp. Công thức HCl cho thấy phân tử bao gồm một nguyên tử hydro liên kết cộng hóa trị với một nguyên tử clo. Trong dung dịch nước, HCl phân ly hoàn toàn thành ion H⁺ và Cl⁻, điều này giải thích vì sao nó được xếp vào nhóm các axit mạnh.
Tính chất vật lý của HCl bao gồm: không màu, có mùi hắc và dễ tan trong nước. Dung dịch HCl có tính ăn mòn cao, phản ứng mạnh với nhiều chất, đặc biệt là kim loại. Khi tác dụng với kim loại, HCl sinh ra khí hydro, muối clorua – một phản ứng đặc trưng được dùng trong các bài kiểm tra hóa học phổ thông.

Một điểm quan trọng nữa là công thức HCl phản ánh tính chất điện ly mạnh. Điều này có nghĩa là dung dịch axit clohidric dẫn điện tốt, được ứng dụng trong nhiều ngành như điện hóa, phân tích định lượng. Ngoài ra, dung dịch HCl còn tham gia vào quá trình chuẩn độ trong phân tích hóa học.
Công thức HCl trong đời sống – Hiểu đúng để ứng dụng hiệu quả
Sau khi nắm được công thức HCl, cùng sackolik tìm hiểu những ứng dụng thực tế rộng rãi của hợp chất này. Ở trong đời sống, giáo dục và công nghiệp.
Trong công nghiệp chế tạo – Công thức HCl là hợp chất không thể thiếu
Axit hydrochloric (HCl) là một trong những hợp chất vô cơ có ứng dụng rộng rãi nhất trong lĩnh vực công nghiệp. Nhờ đặc tính axit mạnh, dễ hòa tan, phản ứng nhanh, HCl được sử dụng như một tác nhân xúc tác.
Hay như chất tẩy rửa trong quy trình sản xuất hóa chất, luyện kim, chế biến thực phẩm, cả xử lý nước thải. Trong ngành luyện kim, HCl dùng để làm sạch bề mặt kim loại trước khi hàn, mạ điện hoặc sơn phủ – một quá trình được gọi là “tẩy gỉ kim loại”.
Ngoài ra, axit này còn được sử dụng để sản xuất PVC (polyvinyl chloride), một loại nhựa quan trọng trong xây dựng, sản xuất đồ gia dụng. HCl còn tham gia trong quá trình tổng hợp các hợp chất vô cơ như clorua kẽm (ZnCl₂), clorua sắt (FeCl₃), hay các muối khác dùng làm chất xúc tác hoặc phụ gia kỹ thuật.

Đặc biệt trong xử lý nước, HCl giúp điều chỉnh pH về mức an toàn, loại bỏ tạp chất ion kim loại nặng. Với mật độ ứng dụng dày đặc như vậy, công thức HCl không chỉ là một ký hiệu học thuật mà còn là mắt xích quan trọng trong chuỗi sản xuất công nghiệp hiện đại.
Trong y học và sinh học – Axit HCl đóng vai trò thiết yếu
Công thức HCl không chỉ đại diện cho một chất hóa học công nghiệp mà còn mô tả một thành phần sinh học cốt lõi trong hệ tiêu hóa con người. Trong dạ dày, axit hydrochloric được tế bào viền (parietal cells) tiết ra nhằm tạo môi trường axit mạnh, có độ pH dao động khoảng 1.5–3.5.
Môi trường này giúp làm biến tính protein từ thức ăn, tạo điều kiện cho enzyme pepsin hoạt động hiệu quả, đồng thời tiêu diệt phần lớn vi khuẩn, vi sinh vật có hại đi theo đường tiêu hóa. Đây là hàng rào bảo vệ sinh học tự nhiên đầu tiên trong cơ thể chống lại các tác nhân gây bệnh từ thực phẩm.
Khi lượng HCl trong dạ dày suy giảm hoặc tăng cao bất thường, hệ tiêu hóa có thể gặp nhiều rối loạn. Nồng độ HCl thấp gây khó tiêu, đầy bụng, còn tình trạng tăng tiết axit lại dẫn đến viêm loét dạ dày – tá tràng, trào ngược thực quản. Do đó, khả năng điều hòa HCl trong cơ thể là yếu tố quan trọng giúp duy trì sức khỏe tiêu hóa ổn định.

Không chỉ trong sinh lý học, công thức HCl còn được ứng dụng rộng rãi trong các phòng thí nghiệm sinh học, y học. HCl được sử dụng để xử lý mô trước khi nhuộm tiêu bản, điều chỉnh pH trong các môi trường nuôi cấy, xúc tác các phản ứng sinh hóa.
Trong lĩnh vực dược phẩm, axit HCl góp phần tạo ra muối hydrochloride – một dạng dẫn xuất có độ tan tốt và dễ hấp thu hơn của nhiều loại thuốc. Chẳng hạn như lidocaine hydrochloride hay metformin hydrochloride.
Phân biệt công thức HCl với các chất tương tự – Cách viết đúng và chính xác
Trong hóa học, công thức HCl thường bị nhầm lẫn với các hợp chất khác như Cl₂ (khí clo), HClO (axit hipoclorơ) hoặc NaCl (muối ăn). HCl là hợp chất của hidro và clo, thuộc nhóm axit mạnh, tồn tại ở dạng khí hoặc dung dịch. Việc nhầm lẫn giữa HCl với các hợp chất khác không chỉ ảnh hưởng đến việc học mà còn dẫn đến sai sót trong thực hành.
Ví dụ, Cl₂ là chất oxy hóa mạnh, độc hại, khác hoàn toàn về tính chất và ứng dụng so với HCl. Axit HClO có tính sát khuẩn nhưng yếu hơn nhiều, trong khi NaCl hoàn toàn không có tính axit. Để cách viết đúng công thức HCl, người học cần chú ý đến cấu trúc hóa học, vai trò của mỗi nguyên tố: một nguyên tử hydro liên kết với một nguyên tử clo.

HCl là axit đơn chức, dễ hòa tan trong nước, tạo ra dung dịch axit mạnh. Trong các kỳ thi hoặc bài kiểm tra, việc phân biệt đúng HCl với các hợp chất liên quan sẽ giúp học sinh, sinh viên đạt được kết quả chính xác hơn. Vì vậy, hiểu và viết đúng công thức HCl là bước đầu tiên trong việc tiếp cận kiến thức hóa học vững chắc, thực hành chuẩn xác.
Xem thêm: Công Thức NaOH – Bí Mật Đằng Sau Hợp Chất Kiềm Mạnh Phổ Biến
Mặt trái của HCl – Cần sử dụng và bảo quản an toàn
Mặc dù công thức HCl biểu thị một hợp chất có vai trò lớn trong nhiều lĩnh vực, nhưng không thể bỏ qua những rủi ro tiềm ẩn khi sử dụng hoặc tiếp xúc với axit này. HCl tồn tại ở dạng khí hoặc dung dịch lỏng, có tính ăn mòn cực mạnh.
Khi hít phải hơi HCl, đường hô hấp có thể bị kích ứng nặng nề, gây ho, đau rát cổ họng, trong trường hợp nghiêm trọng còn dẫn đến phù phổi cấp tính. Đối với da và mắt, tiếp xúc trực tiếp với axit HCl có thể gây bỏng hóa học, tổn thương giác mạc hoặc viêm da. Đây là lý do khiến sackolik luôn khuyến nghị người sử dụng tuân thủ các biện pháp bảo hộ khi thao tác với hóa chất này.
Trong môi trường lưu trữ, axit HCl cần được bảo quản trong các bình chuyên dụng làm bằng vật liệu chịu axit như thủy tinh dày, nhựa polyetylen hoặc nhựa fluorocarbon. Cần tránh bảo quản HCl gần các chất oxy hóa mạnh như kali permanganat, natri hypoclorit hay amoniac – những phản ứng với HCl trong điều kiện không kiểm soát có thể sinh ra khí độc clo (Cl₂), vô cùng nguy hiểm.
Nơi lưu trữ phải thông thoáng, tránh ánh sáng trực tiếp, được dán nhãn đầy đủ. Vì HCl dễ bay hơi, đặc biệt là khi có nhiệt độ cao, các khu vực sử dụng HCl phải trang bị hệ thống thông gió hoặc tủ hút khói để giảm thiểu phơi nhiễm. Trong giảng dạy, thực hành, việc nhận thức rõ mặt trái của công thức HCl là yếu tố bắt buộc nhằm xây dựng thái độ sử dụng hóa chất có trách nhiệm.
Kết luận
Công thức HCl là nền tảng quan trọng giúp người học hiểu đúng bản chất của axit clohidric – một hợp chất phổ biến trong hóa học, đời sống. Việc nắm chắc công thức này không chỉ phục vụ học tập mà còn hỗ trợ ứng dụng thực tế trong các ngành công nghiệp, y học, bảo vệ môi trường. Bài viết chuyên môn được sackolik chia sẻ để hỗ trợ học tập và ứng dụng thực tế hiệu quả.